光的透过和吸收光是具有特定频率 (波长)的电磁辐射。电磁辐射涵盖从宇宙射线到无线电波的范围(图1-1),通常所说的光指的是紫外光(UV)、可见光和红外光,波长范围分别在40~400nm、400~800nm和800nm以上。
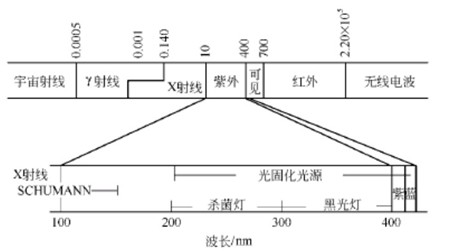
图1-1 各种电磁辐射的范围
紫外光是波长为40~400nm的光,又可分为真空紫外(<200nm)、中紫外 (200~300nm)和近紫外(300~400nm)。在一般光化学研究和光固化应用中有实际意义的是中紫外和近紫外区的紫外光,通常仅划分为 UVA (315~400nm)、UVB(280~315nm)和 UVC(200~280nm)三个波段。一般的光固化体系中应用较多的是UVA和UVB,集成电路制作的光刻技术中则用到UVC段甚至更短波长的光。光固化涂料应用中常常要考虑深层固化的问题,这是由于光穿过吸光物质时其强度会发生衰减。光衰减的程度可以用比尔朗伯(Beer Lambert)定律描述:
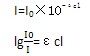
式中,I0为入射光的光强;I为透射光的光强;ε称为摩尔消光系数,与被透过物中吸光物质的性质和入射光的波长有关;c为该吸光物质的浓度;l为光程长。留意上式中吸光物质浓度越大,则光衰减越严重,因此在实际应用中,过高的光引发剂浓度不利于深层固化。光的吸收其本质是光的能量转移到吸光物质,使吸光物质分子由低能量状态转化到高能量状态,例如从基态到激发态。吸收的能量与光的波长有如下关系:
∆E=hν=hc/λ
式中,∆E 为 分 子 激 发 态 和 基 态 的 能 级 差,单 位 J;h 为Planck常数,其值为6.62×10-34J·s;ν为光的频率,单位s;c为光速,其值为3×108m/s=3×1017nm/s;λ为光的波长,单位nm。可见,波长越短则能量越高。紫外光波长比可见光短,因此,其能量较高,会对生物细胞产生破坏作用,所以应尽量避免紫外光对皮肤的辐照。远紫外线能量高,可用来杀菌消毒,通常用的杀菌灯就是主波长为200~300nm的紫外灯。
二、光化学的几个概念
生色团 虽然光的吸收是一个分子整体的性质,但在有机分子中常常可将某一原子或原子集团看作是光吸收的一个单元,称之为生色团 (或发色团)。典型的有机生色团有C=C,C=O和芳香基团等。表1-1列出了一些重要的有机生色团的最大吸收波长、消光系数和激发类型。我们可以利用物质的吸光性估计或判断分子含有怎样的生色团。反过来,也常常通过在分子中引入特定的生色团,从而改变物质的吸光特性。
表1-1 一些重要的生色团的最大吸收波长 (λmax)、 消光系数 (εmax)和激发类型
|
生色团 |
λmax/nm |
εmax |
激发类型 |
|
C |
180 |
1000 |
σ,σ* |
|
C-C-C-C |
220 |
10000 |
σ,σ* |
|
苯 |
260 |
200 |
∏,∏* |
|
萘 |
380 |
10000 |
∏,∏* |
|
C-O |
280 |
20 |
n,∏* |
|
N-N |
350 |
120 |
n,∏* |
|
N-O |
660 |
200 |
n,∏* |
|
C-C-C-O |
350 |
30 |
n,∏* |
|
C-C-C-O |
220 |
20000 |
∏,∏* |
在光引发剂的分子设计中,常常通过改变生色团的结构而实现其作用波长的改变。 量子产率 一个光化学反应的量子产率Φ (或量子效率)可以定义为每吸收一个量子所产生的反应物的分子数,这通常是对于特定的波长而言,即
Φ=(生成产物的分子数)/(吸收的量子数)
同样,也可以将量子产率定义为每吸收一个量子发生反应的分子数。
量子产率的测定对于了解光化学反应的过程和机理非常重要,例如,Φ>1表示存在着链式反应。另外,对于光引发剂的引发效率,量子产率是一个重要的衡量指标。
激发态和电子跃迁 分子可因受热而获得进行化学反应所必需的活化能,而光化学反应的活化能是由分子吸收光能而获得的,两种反应所依据的基本化学理论没有根本的区别,但两者在发生反应时分子的电子排布是完全不同的。热化学反应时分子处于基态,而光化学反应时分子处于激发态。
分子吸收光能后处于较低能级轨道的电子可以向较高能级的轨道跃迁,从而生成激发态分子。这种跃迁必须服从一定的规则。服从这些规则的跃迁是 “允许跃迁”,否则是 “禁阻跃迁”。图1-2中用箭头示出了4种可能的跃进。
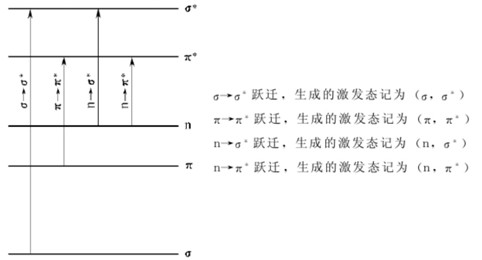
图1-2 4种可能的电子跃进
必须指出的是,所谓 “禁阻跃迁”实际上并不是完全不能发生,只是其发生的概率很小,表现为其消光系数ε值很小,例如n→π跃迁是一种 “禁阻跃迁”,其ε约为10~100L·mol-1·cm-1。
激发态分子具有较高的能量,它们相对于基态而言是不稳定的,可以通过各种途径失去能量而回到基态,这称为失活。如果在失活过程中分子未发生变化,即回到基态的分子是原来的分子,则此过程称为光物理过程;如果分子在激发态发生了化学反应,此时回到基态的分子已不是原来的分子,则此过程为光化学(反应)过程。
激发单线态和激发三线态 电子具有自旋,两个电子的自旋方向可以相同 (即自旋平行),也可以相反(即自旋反平行),分别对应于三线态和单线态。通常以T表示三线态,以S表示单线态。几乎所有的分子在其基态时电子都是配对 (自旋反平行)的,即处于单线态,一般以S0表示。然而激发态分子是由原来配对的2个电子之一跃迁到较高的能级形成的,这2个电子的自旋可能是平行的,也可能是反平行的,相应地称为激发三线态 (T1)和激发单线态 (S1)。
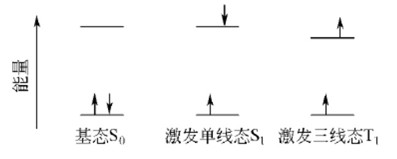
图1-3表示电子跃迁时自旋的情况
三线态的能级常低于单线态的能级,但在分子吸收光能而产生的电子激发态多为单线态,这是因为分子激发时若其多重度保持不变则此跃迁的概率最大。








